|
Внутренняя энергия и способы ее изменения.
Раздел физики, в котором изучаются свойства тел без использования представлений о характере движения и взаимодействия частиц, из которых они состоят, называется термодинамикой.
Термодинамика опирается на некоторые общие законы (" начала "), которые являются обобщением огромного числа опытных фактов.
Совокупность физических тел, изолированную от взаимодействия с другими телами, называют изолированной термодинамической системой.
Состояние термодинамической системы описывается некоторым числом независимых физических параметров. Внутренняя энергия тела складывается из кинетической энергии хаотичного теплового движения составляющих его частей (атомов или молекул) и потенциальнойэнергии их взаимодействия. Кинетическая и потенциальная энергия тела, как целого , во внутреннюю энергию не входит.
Превращения : а) шайба на льду Ек -> U
опыт : б) Нагревание воды в пробирке с пробкой U -> Ек
Посчитать внутреннюю энергию как U = Ек N + Еp N , используя МКТ довольно трудно. Внутренняя энергия идеального газа (одноатомного) газа т.к. молекулы (гелий, неон, аргон) совершают только поступательное движение.
| = |
3 |
kT; N = |
m |
NA; |
|
|
| 2 |
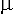 |
| U = |
3 |
kT |
m |
NA |
= |
3 |
|
m |
RT; |
|
|
|
|
| 2 |
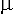 |
2 |
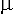 |
Изменение  U = U = |
3 |
|
m |
R T T |
=> U = f ( T ) |
|
|
| 2 |
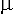 |
| U ~ m; U ~ |
1 |
( от рода вещества ) ( у сложных молекул учитывают вращение молекул ) |
|
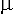 |
| |
|
|
| У реального газа, жидкости и твердого тела |
Ep |
не равно 0. |
|
|
| Ep |
~ V, так как меняется расстояние между молекулами => U ~ f ( T,V ) |
Внутренняя энергия тела изолированной термодинамической системы может изменяться двумя способами: при совершении работы и при теплообмене (теплопередаче) количеством теплоты называется энергия, передаваемая путем теплообмена. Q = c m  T T
c - удельная теплоемкость вещества
 T - изменение температуры. T - изменение температуры.
Изменить внутреннюю энергию тела, можно приведя его в соприкосновение с другим телом, имеющим более высокую или более низкую температуру.
а) При накачивании воздуха в велосипедную шину он нагревается. Молекулы газа получают энергию от поршня (аналогия: нога футболиста и мяч).
б) При расширении газа, молекулы при столкновении с удаляющимся поршнем уменьшают свою скорость и энергию.
в) Вычисление работы. Работа газа.
 |
A' = F' ( h2 - h1 );
F' = p S;
A' = p S ( h2 - h1 ) = p ( S h2 - S h1 ) = p ( V2 - V1 ) = p V V
A' = p  V V |
|
| F' |
- сила, с которой газ действует на поршень |
|
| F |
- сила, действующая на газ со стороны внешнего тела |
расширение газа :
Сжатие газа : A'< 0 - работа газа; A > 0 - работа внешних сил.
При сжатии внешние силы передают энергию, при расширении газ совершает работу, его энергия уменьшается. Графическое (геометрическое) истолкование работы.
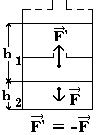
Изобарный процесс
 |
р - пост.
работа численно равна площади фигуры ( в выбранном масштабе ),
закрашенной на рисунке
A' = p V; A' = Sabcd V; A' = Sabcd |
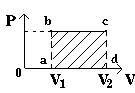
При изменении объема газа часто меняется и его давление. Пусть давление газа уменьшается, выделим небольшие изменения объема  V и на концы каждого участка опустим перпендикуляры. Если V и на концы каждого участка опустим перпендикуляры. Если  V достаточно малы, то получившиеся полоски можно считать прямоугольниками. Площадь каждого из них равна p V достаточно малы, то получившиеся полоски можно считать прямоугольниками. Площадь каждого из них равна p V. Из таких малых прямоугольников складывается вся площадь под графиком зависимости давления от объема. Значит площадь под кривой и выражает в выбранном масштабе работу силы давления газа при его расширении от V1 до V2 V. Из таких малых прямоугольников складывается вся площадь под графиком зависимости давления от объема. Значит площадь под кривой и выражает в выбранном масштабе работу силы давления газа при его расширении от V1 до V2
 |
A' = S abcd |
Количественную меру изменения внутренней энергии при теплообмене называют количеством теплоты.
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии от горячего тела передается холодному
Q = c m ( t2o-t1o ) = c m  to c to c
Q = c m ( T2-T1 ) = c m  T T
c - удельная теплоемкость вещества.
Удельная теплоемкость вещества - это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К. Удельная теплоемкость зависит от рода вещества и от того, при каком процессе осуществляется теплопередача.
Сv - удельная теплоемкость при постоянном объеме;
Сp - удельная теплоемкость при постоянном давлении для идеального газа.
| cp |
= |
Qp
|
= |
 U + A' U + A' |
= |
 U U
|
+ |
A'
|
= cv |
+ |
A'
|
|
|
|
|
|
m  T T |
m  T T
|
m  T T |
m  T T |
m  T T |
cp > cv
| cp |
= cv |
+ |
R
|
|
 |
Теплоемкость моля вещества С =  c; cp = cv + R c; cp = cv + R
Так связаны молярные теплоемкости.
Первый Закон термодинамики. Применение первого Закона термодинамики к изопроцессам в газе.
Анализ результатов опытов и наблюдений природных явлений, выполненных к середине XIX века, привел немецкого ученого Р.Майера, английского ученого Д-Джоуля и немецкого ученого Г.Гельмгольца к выводу о существовании закона сохранения энергии: При любых взаимодействиях тел энергия не исчезает бесследно и не возникает из ничего. Энергия только передается от одного тела к другому или превращается из одной формы в другую. Внутренняя энергия U системы, изолированной от любых взаимодействий с внешней средой, не изменяется при любых взаимодействиях внутри системы.
Следовательно для изолированной системы U = const или  U = 0 U = 0
В термодинамике рассматривают тела, положение центра тяжести которых, практически не изменяется и механическая энергия таких тел остается постоянной. При переходе системы из одного состояния в другое внутренняя энергия может изменяться, как за счет совершения работы, так и за счет передачи теплоты. Изменение внутренней энергии системы, при переходе ее из одного состояния в другое, равно сумме работы внешних сил и количества теплоты, переданной системе:  U = A + Q U = A + Q
Если система изолирована и под ней не совершается работа, и не обменивается теплотой с окружающей средой Q = 0 , то  U = U2 - U1 = 0 т.е. U1 = U2, U = пост. U = U2 - U1 = 0 т.е. U1 = U2, U = пост.
Внутренняя энергия изолированной системы неизменна.
Часто вместо работы внешней силы над системой А рассматривают работу системы А' , A' = -A, получаем Q =  U + A' U + A'
Количество теплоты, переданное системе, идет на изменение внутренней энергии и на совершение системой работы над внешними телами.
Применим первый закон термодинамики к изопроцессам.
При изотермическом расширении и сжатии температура газа не меняется.
T = const,  U = 0; Q = A' U = 0; Q = A'
Если Q > 0 система получает тепло ; A' > 0 газ совершает положительную работу.
Q < 0 - система отдает тепло;
A' < 0, A > 0. Работа внешних сил положительна.
V- пост.  V = 0 , A' = P V = 0 , A' = P V = 0, A' = 0 V = 0, A' = 0
 U = Q, Q > 0, U = Q, Q > 0,  U > 0 - увеличивается U > 0 - увеличивается
Q < 0,  U < 0 - уменьшается U < 0 - уменьшается
Изменение внутренней энергии равно количеству теплоты.
P - пост. При нагревании газа ( передача ему количества теплоты ) происходит увеличение внутренней энергии и совершение работы расширения
Q =  U + A' = U + A' =  U + P U + P V V
При изобарном сжатии газа необходимо внешним силам совершить работу, чтобы давление осталось постоянным. Газ должен отдать окружающим телам некоторое количество теплоты
Q > A ( при сжатии )
 U = A - Q U = A - Q
Q = A - U, U,  U < 0 U < 0
Q = 0 Адиабатным называется процесс изменения объема и давления газа при отсутствии теплообмена с окружающими телами. Быстро текущие процессы могут быть близки к адиабатным, если время за которое происходит изменение объема газа, значительно меньше времени, необходимого для установления теплового равновесия газа с окружающими телами.
Примеры :
а) сжатие воздуха в воздушном огниве (опыт);
б) сжатие воздуха в дизеле;
в) образование облаков.
Q = 0,  U = -A'U - увеличение при сжатии U = -A'U - увеличение при сжатии
 U = AU - уменьшение при расширении U = AU - уменьшение при расширении
Температура воздуха при адиабатном расширении понижается.
Опыт: с вылетающей из бутылки пробки, содержащей насыщенный водяной пар, при накачивании в нее воздуха, в ней образуется туман.
Поскольку, при адиабатном сжатии температура газа повышается, давление растет быстрее, чем при изотермическом процессе.
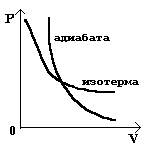 |
Понижение температуры при адиабатном расширении
приведет к тому, что давление убывает быстрее.
На графике адиабата идет круче изотермы. |
Необратимость тепловых процессов в природе. Второй закон термодинамики.
Проблема 1. Все ли процессы могут протекать в природе, хотя с точки зрения I закона термодинамики, возможны. Этот закон "запрещает" лишь получение большей работы, чем было затрачено энергии.
2. Рассмотрим следующие процессы :
а) Передача тепла от горячего тела холодному.
б) Сжатый газ, находящийся под поршнем, расширяется до тех пор, пока его давление не станет равным внешнему давлению. Газ займет весь предоставленный объем. Сжать газ можно только действуя внешней силой. При этом в окружающих телах произойдут изменения: тело, которое сжимает газ, совершает работу, а следовательно и теряет некоторую энергию. Примеры необратимых процессов.
в) Превращение механической энергии во внутреннюю.
г) Затухание колебаний маятника.
д) Процесс диффузии.
Механические процессы, протекающие без трения обратимы ( в консервативных системах). Реальные процессы в природе, протекающие с трением, необратимы. Процесс превращения механической энергии во внутреннюю необратим. Процессы, обратные которым самопроизвольно не происходят, называются необратимыми. Необратимыми называют такие процессы, которые могут самопроизвольно протекать только в одном определенном направлении, в обратном направлении они могут протекать только как одно из звеньев более сложного процесса.
При наличии сильного состава класса можно кратко рассказать, используя диафильм " Необратимость тепловых процессов ", на ничтожно малую вероятность тепловых процессов.
Второй закон термодинамики указывает направление воэможныж энергетических превращений и тем самым выражает необратимость процессов в природе.
Закон был установлен на основании обобщения опытных фактов. Несколько формулировок.
Р.Клаузиус ( 1822 - 1888 г.)
Невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих или окружающих телах. Разумеется, совершая работу за счет внешнего источника энергии, можно отбирать энергию у холодного тела к горячему. Это, например, происходит в холодильниках, где такой процесс совершается за счет работы двигателя, потребляющего электрическую энергию.
Второй закон термодинамики носит вероятностный характер. В отличии от закона сохранения энергии, который может быть применен к отдельным атомам и молекулам, второй закон термодинамики применим лишь к системам,состоящим из очень большого числа частиц. Для таких систем необратимость процессов объясняется тем, что обратный переход должен был бы привести систему в состояние с ничтожно малой вероятностью, практически неотличимой от невозможности.
Второй закон термодинамики позволяет понять, почему некоторые источники энергии, находящиеся вокруг нас бесполезны. Заманчивым кажется использование почти безграничного запаса внутренней энергии, содержащейся в атмосфере и водах океанов. Нетрудно оценить, каким запасом внутренней энергии обладает окружающая Землю атмосфера, масса которой, примерно 10 18 кг.
Еще большим запасом внутренней энергии обладают моря и океаны. Масса воды в Мировом океане 1021 кг. Охлаждение только на один градус привело бы к выделению энергии порядка 1024 Дж. Это в 10 000 раз больше всей энергии, вырабатывающейся на Земном шаре за год.
Однако эту внутреннюю энергию не причисляют к энергетическим запасам.
Ведь для получения работы за счет этой энергии необходимо иметь столь же огромный холодильник, который принимал бы часть этого огромного количества теплоты и при этом не нагревался сам до температуры океана.
Но работа двигателя без холодильника запрещена вторым законом термодинамики.
Тепловые процессы необратимы, из утверждения Клаузиуса следует, что со временем энергия Вселенной преобразуется в энергию теплового движения, а последняя путем теплообмена перераспределится между телами и во всех участках мира установится одинаковая температура. Вселенная придет в состояние равновесия, при которых исчезнут причины, вызывающие те или иные процессы. Энергия системы потеряет способность превращаться в другие виды. Не смогут преобразовать теплоту в работу и тепловые машины, для их действия нужно иметь различно нагретые тела. Наступит "тепловая смерть" Вселенной.
Ошибка в постановке вопроса о "тепловой смерти" Вселенной заключается в следующем: второе начало термодинамики установлено для термодинамической системы конечных размеров. Вселенную же нельзя рассматривать как такую систему. К ней нельзя применять понятия "изолированная система", "равновесное состояние". Обобщение, сделанное Клаузисом о тепловой смерти Вселенной, выходит ва границы применимости термодинамики и поэтому незаконно.
Тепловые двигатели. КПД теплового двигателя.
а) тепловой двигатель совершает работу в результате перехода энергии от горячего тела к холодному. Газ расширяется, движет поршень, движение поршня передается валу двигателя. Для сжатия газа поршень должен переместиться под действием внешней силы в противоположном направлении. Это движение совершается за счет кинетической энергии маховика. Если работа при сжатии газа под действием внешней силы по абсолютному значению равна работе, совершаемой при расширении гаэа, то общая работа за весь цикл будет равна нулю. Отсюда следует, что если мы хотим получить полезную работу, то работа сжатия должна быть меньше работы расширения.
б) Нагреватель. Его роль.
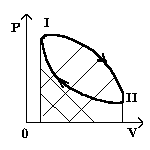 |
Aст < Арас; Аст < 0; Арас >0 |
Полезная работа численно равна площади фигур между кривыми.
в) Роль холодильника. Газ перед сжатием должен охладиться.
о
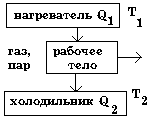 |
A' = |Q1|-|Q2|;
A' = -A = - U U |
3. КПД двигателя. A' = |Q1|-|Q2|
к.п.д. = 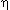 |
= |
A'
|
|
= |
|Q1|-|Q2| |
= 1 - |
|Q2| |
< 1 |
|
|
|
| |Q1| |
|Q1|
|
|Q1| |
КПД двигателя всегда меньше 100 %.
4. Максимальный КПД идеальной тепловой машины.
Идеальный газ - рабочее тело. Цикл Карно.
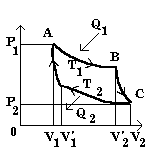
В классах с сильным составом можно разобрать цикл Карно (1824 г.) подробно
5. Пути повышения КПД:
1) повышение температуры нагревателя;
2) понижение температуры холодильника ;
3) уменьшение потерь энергии в частях двигателя.
В заключении лекции класс совместно с учителем решает задачу.
1. Задача : Паровая машина мощностью N = 14,7 кВт потребляет за 1 час работы m = 8,1 кг угля с удельной теплотой сгорания q = 3,3 . 107Дж /кг Температура котла 200 oC, холодильника 58oС. Найдите КПД этой машины и сравните с КПД идеальной тепловой машины.
Дано: m = 8,1 кг; N = 1,47 . 103Дж/кг; T1= 473 K; T2 = 331 K
t = 1 час = 3600 сек.; q = 3,3 . 107 Дж/кг.
Вопрос:  -? -? 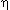 max-? max-?
Решение:
Q = mq - получено при сгорании; A = Nt - произведенная работа
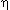 |
= |
A |
= |
N.t |
= |
1,47 . 103Дж/кг . 3600с |
= 0,198; 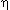 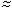 20 % ; 20 % ; |
|
|
|
| Q1 |
m.q |
3,3 . 107 Дж/кг . 8,1 кг |
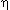 max max |
= |
T1-T2 |
100 %; 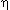 max max |
= |
473 К - 231 К |
100 % = 30 %; 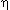 < < 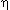 max max |
|
|
|
T1
|
473 K
|
2. Задача : Дано:
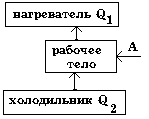 |
Идеальная тепловая машина с КПД 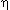 работает по обратному циклу. работает по обратному циклу.
Какое максимальное количество теплоты можно забрать от холодильника, совершив механическую работу А - ?
|
Поскольку холодильная машина должна работать по обратному циклу, то для перехода тепла от менее нагретого тела к более нагретому, необходимо, чтобы внешние силы совершили положительную работу :
от холодильника отбирается количество теплоты Q2, внешними силами совершается работа и нагревателю передается Q1.
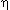 |
= |
A |
= |
|Q1 | - | Q2 | |
; Q2 = Q1 ( 1 - 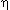 ) ) |
|
|
| Q1 |
| Q1 |
|
|